课题组在微藻油脂代谢转录调控方面取得新进展(2022-3-28)
“浮光不解藻意浓,长照此间有时空,奈何体宽多油腻,只因身在困境中”。
在营养充足和环境适宜条件下,微藻生长旺盛(fit状态);而当处于营养不足或者环境胁迫时,微藻生长受抑制,细胞变大并倾向于合成积累甘油三酯(fat状态)(图1)。
如何把微藻和中年男人关联起来?两个词:困境与油腻。微藻告诉你,为什么会油腻,因为太大压力;如何控制油腻,关键得看MYB。油腻,其实也是一种选择。如果说,中年男人选择油腻,是在面临困境时随波逐流式的无奈躺平;那么,真核微藻选择油腻,则是应对逆境时自我保护式的抗争救赎。
甘油三酯是一种常见的储能分子,也是生物能源的理想原料。尽管已有不少关于微藻油脂代谢途径功能基因的研究报导,但在油脂代谢合成甘油三酯的转录调控方面仍所知较少。
近日,北京大学工学院能源与资源工程系刘进课题组在知名期刊New Phytologist在线发表了题为“A conserved MYB transcription factor is involved in regulating lipid metabolic pathways for oil biosynthesis in green algae”的研究论文,揭示了R2R3-MYB转录因子(MYB1)在调控微藻油脂代谢合成甘油三酯中的作用机制(论文链接:https://doi.org/10.1111/nph.18119)。
该研究首先以佐夫色绿藻(Chromochloris zofingiensis)开展研究。该藻易培养,能够在多种营养模式下同时合成甘油三酯和虾青素,被认为是实现油脂和虾青素多联产的重要种质资源之一。通过转录共表达分析探究了参与油脂代谢调控的潜在转录因子以及它们的调控网络;然后,选定其中一个R2R3-MYB转录因子(命名为CzMYB1),结合酵母单杂交实验、凝胶阻滞迁移实验和启动子序列分析等结果,证明CzMYB1受胁迫诱导上调表达,很可能作为全局正调控因子参与调控该藻的油脂代谢。
由于佐夫色绿藻的遗传操作困难,CzMYB1的功能和作用机制尚缺乏遗传证据的支撑。而与佐夫色绿藻近缘的莱茵衣藻(Chlamydomonas reinhrdtii)属于模式藻,其转化和遗传工具成熟。该研究发现,CzMYB1在莱茵衣藻中的同源转录因子(命名为CrMYB1)同样受胁迫诱导显著上调表达,且与多个油脂代谢关键基因在转录水平存在显著的共表达相关性,包括脂肪酸从头合成(de novo synthesis)、活化(activation)和去饱和(desaturation)途径上的CrCTα、CrCTβ、CrFAT1、CrLACS1、CrLACS2、CrFAD5A、CrFAD6A和CrDES,甘油三酯组装(TAG assembly)途径上的CrLPAAT2、CrPAH1、CrDGTT1和 CrDGTT3,脂滴生成(lipid droplet biogenesis)中的CrMLDP,以及多个作用于脂质重塑(lipid remodeling)的脂酶基因。CrMYB1的插入突变大幅抑制了CrMYB1的转录表达,导致了多个油脂代谢关键基因的表达下调,使得缺氮胁迫下的油脂含量显著减少,其中甘油三酯减少的幅度最大(高达66%)。这些基因的启动子区域都存在着能被CrMYB1识别结合的DNA元件。
综合起来,研究人员提出了一个工作模型来阐释MYB1在调控微藻油脂代谢合成甘油三酯的作用机制(图1)。MYB1转录因子在绿藻中保守存在,受胁迫诱导表达,通过识别 CNGTTA元件来转录激活参与脂肪酸从头合成、活化和去饱和、膜脂周转、脂滴生成以及甘油三酯组装等通路中的关键基因的表达,从而控制甘油三酯在藻细胞中的积累。活性氧(ROS)在胁迫条件下积累,可能作为信号分子触发MYB1的表达。该转录因子系微藻中首个被发现的油脂代谢全局调节子,是理想的单基因工程靶点,在理性代谢工程改造微藻提高油脂含量方面有极大的应用潜力。
图1 MYB1调控微藻油脂代谢合成甘油三酯(TAG)的工作模式图
北京大学工学院能源与资源工程系刘进为该论文的通讯作者,2017级直博生史美程为第一作者。此项工作系该课题组揭示长链脂酰CoA合成酶(LACS)成员在微藻油脂代谢应对环境变化中的作用机制(New Phytologist, 2022)后的又一成果,得到了科技部国家重点研发计划(2018YFA0902500)和国家自然科学基金面上项目(32072183, 31770048)的支持。
课题组揭示了长链脂酰CoA合成酶成员在藻类脂质代谢应对环境变化中的作用机制(2021-10-20)
近日,北京大学工学院能源与资源工程系刘进课题组在New Phytologist杂志在线发表了题为Long-chain acyl-CoA synthetases activate fatty acids for lipid synthesis, remodeling and energy production in Chlamydomonas的研究论文,揭示了莱茵衣藻长链脂酰CoA合成酶成员在脂质代谢应对环境变化中的作用机制。该论文链接为https://nph.onlinelibrary.wiley.com/doi/abs/10.1111/nph.17813。
低碳是全球发展的方向。中国承诺于2035年前实现‘碳达峰’和2060年前实现‘碳中和’。藻类有潜力在‘双碳’行动中发挥重要作用。藻类通过光合作用固定CO2并释放氧气,是地球碳-氧循环的重要参与者。保守估计,藻类固定了地球上超过40%的CO2,是地球至关重要的初级生产力。藻类将固定的CO2转化成多种物质储存在细胞内。其中甘油三酯(TAG)是一种常见的储能物质,可达藻细胞干重的50%,是生产生物能源的理想原料。阐明脂质代谢机理将为工程改造藻类提高油脂含量和产量提供重要启示。
作为模式藻,莱茵衣藻 (Chlamydomonas reinhrdtii) 被广泛用来研究脂质代谢。TAG的积累由合成和降解代谢控制。正常生长情况下,衣藻中从头合成的脂肪酸(FA)主要分配到膜脂。当生长受到胁迫时,TAG大量合成,储存FA。当胁迫去除时,TAG降解,释放的FA进入β-氧化途径,为细胞再生长提供碳源和能量来源。不论是进入TAG还是进入β-氧化途径,FA需要被活化成脂酰CoA,由长链脂酰CoA合成酶(LACS)催化。因此,LACS在脂质代谢中扮演着重要的角色。衣藻有3个LACS(LACS1,LACS2和LACS3),尽管已有研究报道衣藻LACS2参与了TAG合成 ,它们的生化特征以及在维持衣藻脂质稳态应对环境变动中的作用仍然不甚清楚。
为此,我们首先通过体外酶活分析发现LACS1,LACS2和LACS3都能够催化多种FA,且没有明显的底物偏好性。当从氮充足(NR)转到氮缺乏(ND)条件下,衣藻中总脂肪酸(TFA)和TAG含量增加, LACS1和LACS2转录水平大幅上调,而LACS3保持低转录水平。当从ND转到氮回复(NDR)条件下,衣藻中TFA和TAG含量下降,LACS1和LACS2转录水平急剧下调,然后再次上调,而LACS3转录水平大幅上调。为进一步研究它们的功能,我们对每个基因的缺失突变体(crlacs1-1, crlacs2-1, crlacs3-1)开展了生理、生化(脂质组学)和遗传分析。生长方面,1)NR和ND条件下,缺失突变体与野生型都没有明显区别;2)NDR条件下,野生型快速生长,而缺失突变体的生长明显受损,其中crlacs3-1的生长几乎停止。脂质方面,1)NR条件下,缺失突变体和野生型没有明显区别;2)ND条件下,crlacs1-1和crlacs2-1的TFA和TAG含量都显著低于野生型,而半乳糖脂(叶绿体膜成分)显著高于野生型;3)NDR条件下,野生型的TAG快速降解,crlacs1-1和crlacs2-1的TAG降解速率与野生型相似,而crlacs3-1的TAG降解严重受损。缺失突变体的回补能够回复相关表型。此外,比较转录学分析表明,缺失突变体中的脂质变化很可能是由代谢调整而非转录重编程引发。
综合起来,我们提出了一个工作模型来阐释衣藻LACS成员的功能和生理作用(图1)。多个细胞器参与脂质代谢,包括叶绿体,内质网,脂滴和过氧化物酶体。LACS1, LACS2 和 LACS3将这些细胞器联系起来,通过时空的精妙合作来维系衣藻脂质稳态。LACS1和 LACS2位于内质网和(或者)脂滴,都参与活化FA供正常生长情况下内质网膜脂的合成;缺失LACS1和 LACS2会分别激活LACS2和 LACS1的转录上调来补偿,从而避免影响膜脂合成和细胞生长。当面临胁迫比如ND,LACS1和LACS2转录水平受诱导大幅上调,为内质网膜上的酰基转移酶(比如DGAT)提供充足的脂酰CoA来合成TAG;另一方面,位于过氧化物酶体中的LACS3转录水平维持在低水平以减少FA β-氧化和TAG降解,从而保证TAG的大量积累。LACS1 和 LACS2功能上有重叠,但两者对于TAG合成都是必不可少的。当胁迫去除时,LACS3受诱导大幅上调,与TAG降解相关的脂酶(比如LIP1和LIP4)和FA β-氧化相关的酶(比如ACX2)协作来实现TAG的再利用,为细胞再生长提供碳源和能量来源。与此同时,LACS1 和 LACS2再次上调表达,为细胞快速生长所需的膜脂提供充足的脂酰CoA。
北京大学工学院能源与资源工程系刘进为该论文的通讯作者,已出站博士后白帆为第一作者,法国原子能与替代能源研究所和艾克斯-马赛大学的Li-Beisson教授作为共同作者参与其中。该项工作得到了国家自然科学基金面上项目(31770048)和科技部国家重点研发计划(2018YFA0902500)的支持。
Plant Physiology配文介绍我们于2020-05-08在线发表的研究成果(2020-07-04)
Plant physiology于同期以题为“An Alternative Route for Astaxanthin Biosynthesis in Green Algae”配文介绍我们微藻虾青素生物合成研究成果 (http://www.plantphysiol.org/content/183/3/812)
课题组在微藻虾青素生物合成研究方面取得重要进展(2020-05-08)
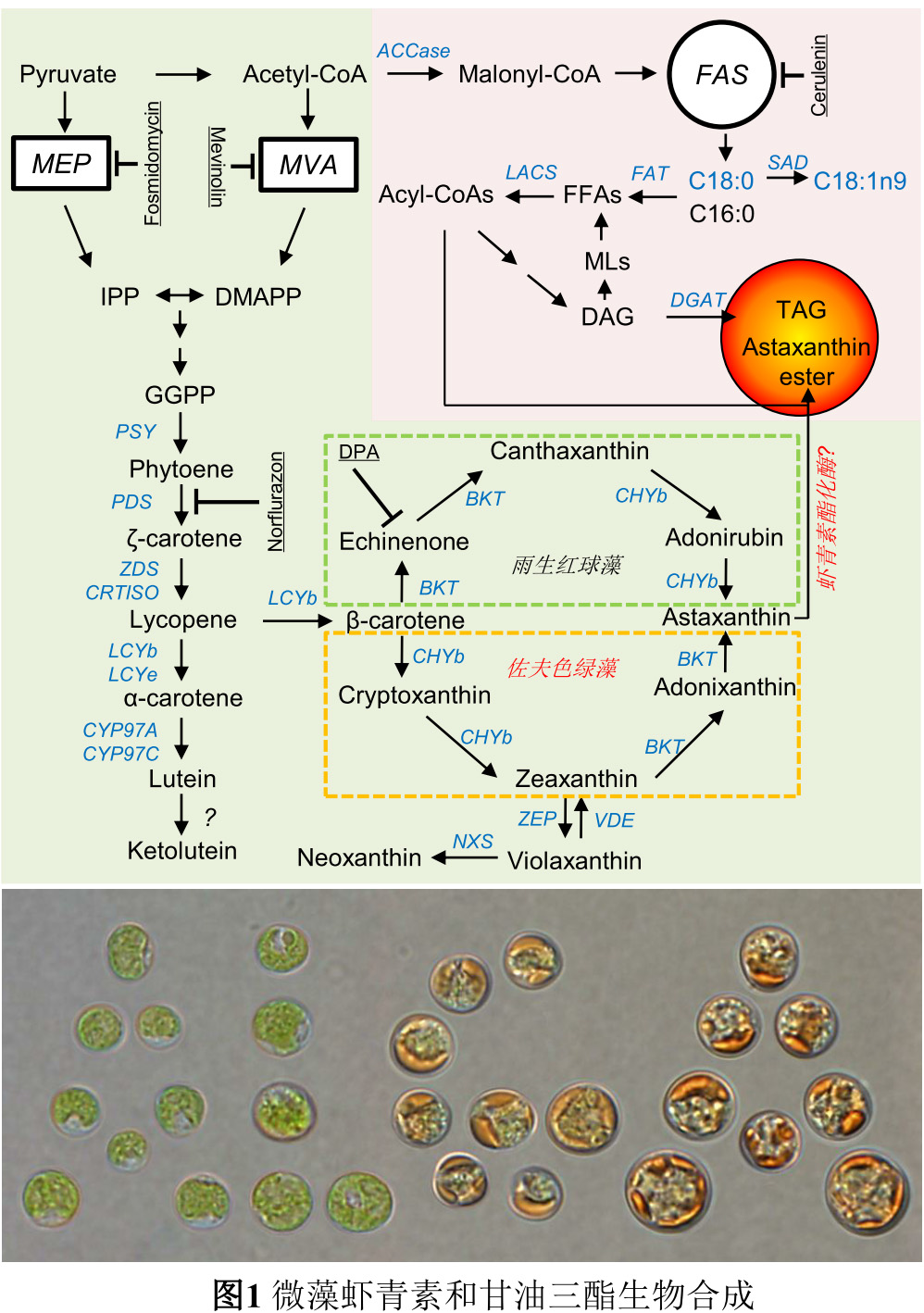
微藻是古老的微生物,绝大多数能够进行光合作用,固定CO2并释放氧气,是地球碳-氧循环的重要参与者;保守估计,藻类固定了地球上超过40%的CO2,是地球至关重要的初级生产力。微藻具有光能利用效率高、生长快、环境适应性强、不与粮争地等多方面的优势,被誉为理想的光驱细胞工厂。微藻能将固定的CO2转化成油脂和碳水化合物等储能物质,以及一系列的高值产物,包括类胡萝卜素(如虾青素、岩藻黄素、叶黄素等)和多不饱和脂肪酸(如EPA、DHA、ARA等)。其中,佐夫色绿藻(Chromochloris zofingiensis)易培养,能够在多种营养模式下合成积累虾青素和甘油三酯(TAG),且有染色体水平的全基因组序列,被认为是研究类胡萝卜素生成和脂质生成的新兴模式藻和实现油脂和虾青素多联产的重要种质资源之一。
课题组以佐夫色绿藻为研究对象,前期工作探究了TAG合成机制[1]和油脂代谢途径中重要基因的功能[2,3],阐释了氮缺乏胁迫下虾青素合成机制[4]和盐胁迫下虾青素和TAG合成机制[5],开发了‘异养发酵-光诱导’获得富含虾青素的高密度细胞的方法[6]。然而与雨生红球藻相比,佐夫色绿藻的虾青素含量偏低,且积累了一些中间产物包括角黄素(Canthaxanthin)和金盏花黄质(Adonixanthin)。这可能与两种藻中虾青素的具体合成途径和调控机制不同有关。
基于前期工作基础,课题组在佐夫色绿藻虾青素生物合成方面取得进展, 研究成果5月8日在线发表于植物学TOP期刊《Plant Physiology》(http://www.plantphysiol.org/content/early/2020/05/08/pp.20.00325)。该研究通过抑制剂分析和体外酶活实验揭示了:1)佐夫色绿藻β-类胡萝卜素羟化酶(CHYb)不能催化角黄素的羟基化来生成虾青素,导致角黄素作为终产物之一积累;2)β-类胡萝卜素酮化酶(BKT)能够催化玉米黄质(Zeaxanthin)的酮基化来生成虾青素。也就是说,该藻中的虾青素合成主要来源于玉米黄质的酮基化而非角黄素的羟基化,与雨生红球藻中的合成途径相反(图1)。虾青素主要以酯化形式(单酯和双酯)存在,与TAG一起储存于脂滴(Lipid droplets)中。抑制脂肪酸的从头合成大幅降低了TAG的积累,并增加了虾青素的合成(尤其是双酯),导致虾青素/TAG的比重提高了5倍,同时将碳流导向了淀粉合成。虾青素的增加很可能来自于其它类胡萝卜素的转化,而不是类胡萝卜素代谢流的整体提高。这也与雨生红球藻中虾青素和TAG的交互作用机制相反。总的来说,该研究解阐明了佐夫色绿藻中虾青素生物合成的具体途径和调控机制,探讨了不同微藻来源的BKT和CHYb在功能演化上的差异,完善了我们对微藻虾青素生物合成的现有认知,并提出了一种提高微藻虾青素含量和纯度的策略。
该研究得到了科技部重点研发计划等项目的资助。北京大学工学院刘进为论文的通讯作者,马里兰大学环境科学中心李彦韬教授和亚利桑那州立大学Henri Gerken博士参与了该项研究。